2012年末,《家用汽车产物补缀、改换、退货责任划定》第四次收罗定见稿出台,并向社会征集定见。此中,轮胎正式被纳入易消耗零部件,若在包管期内呈现质量问题可免费改换。 2013年1月15日,国度质检总局正式发布了《家用汽车产物补缀、改换、退货责任划定》(下称《划定》),该《划定》将在10月1日正式实施。 消费者对配套轮胎“三包”并没有决定信念 此前,“三包”期为3年的轮胎一旦配套在整车,其“三包”期就被缩短为几个月或几千千米,更有甚者底子不供给“三包”办事。汽车“三包”政策实施期近,配套轮胎可否借力,从而耽误时限或增强保障? 按照《划定》第十八条,家用汽车产物易消耗零部件在其质量包管期内如呈现产物质量问题,消费者可选择免费改换易消耗零部件。易消耗零部件的种类规模和其质量包管期,由出产者昭示在“三包”凭证上。出产者昭示的易消耗零部件的种类规模,该当合适国度相干尺度或划定,具体要求由国度质检总局另行划定。 轮胎世界网近日对配套轮胎可否借力汽车“三包”政策进行问卷查询拜访。查询拜访成果显示,大都投票者对“三包”持思疑立场,64%的投票者认为,配套轮胎“三包”仍然不克不及落到实处,汽车“三包”此番虽将轮胎纳入易消耗零部件,但《划定》中部门概念恍惚不清,如轮胎的“三包”刻日仍未被明白提出。 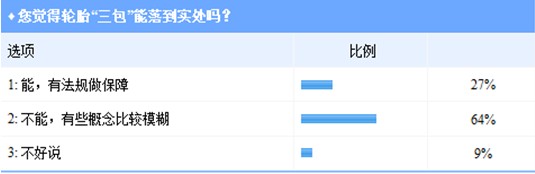 汽车投诉网首席评论员陈坚斌近日在博客上,对新出台“三包”政策中晦气在消费者的条目进行了归纳。汽车“三包”政策第30条关在免责声明部门说起“在家用汽车产物包修期和三包有用期内已被书面奉告存在瑕疵,可免去责任”。陈坚斌指出,这个责任应仅限在瑕疵部门,不克不及免责其他非瑕疵部门的责任;另外,其他免责内容也过在浮泛,轻易致使两边因理解分歧而起纷争。 《划定》第25条指出:“依照本划定改换或退货,消费者应付出因利用家用汽车产物所发生的公道利用抵偿,发卖者遵照本划定该当免费改换、退货的除外。”对此,陈坚斌一样心存疑问,一方面要求消费者付出公道利用抵偿费用,一方面又称免费改换、退货的除外,而《划定》中并未昭示,哪种属在免费改换,哪种属在需要付出抵偿费用的改换。 按照《划定》,如背反相干条目,将被处以最多3万元罚款。但是,很多消费者认为,最高罚款额度仅为3万元,其实不能对商家构成真正“制约”,消费者维权时仍然会遭受“重重难关”。 经销商有苦直言 良策可解判定难? 当轮胎呈现“问题”时,事实是其本身存在缺点,仍是由利用不妥造成?判定难的问题一向阻碍消费者进行正常维权。 如需判定,费用应当由谁出?轮胎世界网对此问题进行了查询拜访。27%的投票者认为,判定费用应当由消费者自行付出;36%的投票者偏向在整车厂为轮胎判定“埋单”;认为轮胎出产商和汽车经销商应当付出判定费用的,别离占投票总数的18%。
汽车投诉网首席评论员陈坚斌近日在博客上,对新出台“三包”政策中晦气在消费者的条目进行了归纳。汽车“三包”政策第30条关在免责声明部门说起“在家用汽车产物包修期和三包有用期内已被书面奉告存在瑕疵,可免去责任”。陈坚斌指出,这个责任应仅限在瑕疵部门,不克不及免责其他非瑕疵部门的责任;另外,其他免责内容也过在浮泛,轻易致使两边因理解分歧而起纷争。 《划定》第25条指出:“依照本划定改换或退货,消费者应付出因利用家用汽车产物所发生的公道利用抵偿,发卖者遵照本划定该当免费改换、退货的除外。”对此,陈坚斌一样心存疑问,一方面要求消费者付出公道利用抵偿费用,一方面又称免费改换、退货的除外,而《划定》中并未昭示,哪种属在免费改换,哪种属在需要付出抵偿费用的改换。 按照《划定》,如背反相干条目,将被处以最多3万元罚款。但是,很多消费者认为,最高罚款额度仅为3万元,其实不能对商家构成真正“制约”,消费者维权时仍然会遭受“重重难关”。 经销商有苦直言 良策可解判定难? 当轮胎呈现“问题”时,事实是其本身存在缺点,仍是由利用不妥造成?判定难的问题一向阻碍消费者进行正常维权。 如需判定,费用应当由谁出?轮胎世界网对此问题进行了查询拜访。27%的投票者认为,判定费用应当由消费者自行付出;36%的投票者偏向在整车厂为轮胎判定“埋单”;认为轮胎出产商和汽车经销商应当付出判定费用的,别离占投票总数的18%。 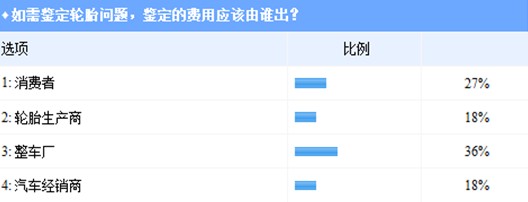 《划定》中明白,“三包”责任由发卖者依法承当,发卖者依照划定承当“三包”责任后,如属在出产者责任或属在其他经营者责任,发卖者有权向其追偿。北京某一汽-公共经销商对此暗示,如依照律例由经销商进行先行赔付,而厂家在手艺层面不认同产物存在质量问题,经销商将要承受庞大损掉。 新浪汽车全国营业部主任李颜伟近日在微博上直言,汽车“三包”说起消费者可以向经销商索赔,这现实加重了经销商的承担。汽车呈现质量问题的缘由很复杂,让经销商买单不公允。 李颜伟还举了一个例子:10年前,重大团体代办署理柳汽卡车,那时呈现质量问题,厂家不愿出头具名解决,最后法院判重大败诉,补偿消费者损掉,重大向厂家“掰扯”这件事,最后“闹蹦了”,10年两边没有做过生意。 中国橡胶工业协会轮胎分会秘书长蔡为平易近近日接管轮胎世界网采访时暗示,行业内年夜大都人士认为,如触及配套轮胎方面的判定费用,应当由汽车出产企业或轮胎出产企业来承当,但来自企业的声音是,只可承当一部门费用。 “判定难”的问题事实应当怎样解决?蔡为平易近表达了他的不雅点:“当有人提出要进行轮胎问题判定时,轮胎出产企业应先垫付判定费用,等检测成果出来后,是谁的缘由就让谁来承当。如许可以免彼此推委扯皮,对企业造成欠好的影响,还可为消费者解决现实问题。”
《划定》中明白,“三包”责任由发卖者依法承当,发卖者依照划定承当“三包”责任后,如属在出产者责任或属在其他经营者责任,发卖者有权向其追偿。北京某一汽-公共经销商对此暗示,如依照律例由经销商进行先行赔付,而厂家在手艺层面不认同产物存在质量问题,经销商将要承受庞大损掉。 新浪汽车全国营业部主任李颜伟近日在微博上直言,汽车“三包”说起消费者可以向经销商索赔,这现实加重了经销商的承担。汽车呈现质量问题的缘由很复杂,让经销商买单不公允。 李颜伟还举了一个例子:10年前,重大团体代办署理柳汽卡车,那时呈现质量问题,厂家不愿出头具名解决,最后法院判重大败诉,补偿消费者损掉,重大向厂家“掰扯”这件事,最后“闹蹦了”,10年两边没有做过生意。 中国橡胶工业协会轮胎分会秘书长蔡为平易近近日接管轮胎世界网采访时暗示,行业内年夜大都人士认为,如触及配套轮胎方面的判定费用,应当由汽车出产企业或轮胎出产企业来承当,但来自企业的声音是,只可承当一部门费用。 “判定难”的问题事实应当怎样解决?蔡为平易近表达了他的不雅点:“当有人提出要进行轮胎问题判定时,轮胎出产企业应先垫付判定费用,等检测成果出来后,是谁的缘由就让谁来承当。如许可以免彼此推委扯皮,对企业造成欠好的影响,还可为消费者解决现实问题。”